La misura del calore
Poiché si tratta di una forma di energia, il calore viene misurato nel Sistema Internazionale in joule (J). Per lungo tempo, però, è stata usata come unità di misura del calore la caloria (simbolo cal), definita come la quantità di calore necessaria per portare la temperatura di 1 g di acqua distillata da 14,5 °C a 15,5 °C, a pressione standard (1 atm o 101,325 Pa). La relazione tra caloria e joule è data da:
Ancora oggi, per esprimere il contenuto energetico di un alimento viene usato un multiplo della caloria, la kilocaloria (1 kcal = 1000 cal).
Il calore specifico
Quando si fornisce calore a un corpo, l'aumento di temperatura che ne consegue dipende dalla massa e dalla natura del corpo stesso, ovvero dal materiale di cui è costituito. Si definisce a questo proposito il calore specifico di una sostanza (e si indica con c) la quantità di calore da fornire all'unità di massa di quella determinata sostanza per innalzare la sua temperatura di 1 °C. Nel Sistema Internazionale il calore specifico si misura in J/kg K, ma anche in questo caso è ancora in uso l'unità di misura riferita alla caloria cal/g °C (la scelta convenzionale della caloria fu fatta proprio per rendere il calore specifico dell'acqua pari a 1 cal/g °C).
Il calore specifico di una sostanza varia leggermente con la temperatura ed è caratteristico di ogni sostanza (v. tab. 11.1). La sostanza che possiede il calore specifico più elevato è l'acqua (occorre cioè una maggiore quantità di calore per innalzare di una unità la temperatura di una certa massa d'acqua, piuttosto che per innalzare la temperatura di una uguale massa di un'altra sostanza). Il calore specifico dei gas varia a seconda che venga misurato mantenendone costante il volume oppure la pressione.
Il prodotto del calore specifico di un corpo e della sua massa è detto capacità termica del corpo e si indica generalmente con C.
La quantità di calore Q necessaria per provocare una variazione ?T nella temperatura di una massa qualsiasi m di una sostanza, dipende dunque dalla massa e dal calore specifico c, secondo la relazione:
La variazione della temperatura T può essere misurata indifferentemente in gradi centigradi o in kelvin, poiché i due si equivalgono, ma generalmente in fisica si usa la notazione riferita al kelvin (e in questo caso la temperatura viene espressa dalla T maiuscola).
Il calorimetro
Lo strumento per misurare le quantità di calore cedute o assorbite da un corpo o da una sostanza, nonché le proprietà termiche della sostanza (come, per esempio, il calore specifico) è il calorimetro. Il calorimetro è costituito da un recipiente isolato termicamente, che contiene una massa nota di acqua della quale si conosce la temperatura. Si basa sul principio della conservazione dell'energia, che in questo caso significa che tutto il calore assorbito o ceduto dall'acqua contenuta nello strumento resta all'interno dello strumento stesso e di conseguenza viene utilizzata per innalzare la sua temperatura. Mediante un termometro inserito nel calorimetro si misurano le variazioni di temperatura, legate al calore assorbito o ceduto attraverso la relazione Q = mcT.
Il calorimetro viene usato, in particolare, per misurare il calore prodotto durante una combustione (v. fig. 11.2), una reazione chimica di ossidazione di una sostanza (il combustibile) con un'altra sostanza (il comburente) che sviluppa grandi quantità di calore. In questo caso la reazione viene innescata con una resistenza elettrica all'interno di una camera di reazione immersa in una massa m di acqua di valore noto. Il calore che si sviluppa nella reazione si trasferisce all'acqua e ne innalza la temperatura, la cui variazione viene misurata con un termometro. Nel calorimetro viene generalmente inserito anche un agitatore, il cui scopo è quello di uniformare la temperatura della massa d'acqua.
| |||||||||||||||||||||||
Media correlati
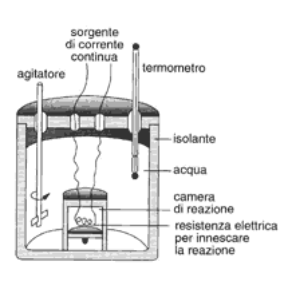
Figura 11.2 Calorimetro per la misura dei calori di combustione.


