I composti del nucleo atomico
Il nucleo è la parte centrale dell'atomo, con dimensioni dell'ordine di 10-15 m, (circa 10.000 volte inferiori a quelle atomiche), dove si concentra la quasi totalità della massa dell'atomo. Il nucleo è carico positivamente e, poiché l'atomo è complessivamente neutro, la sua carica è tale da controbilanciare la carica negativa degli elettroni atomici. Rutherford ipotizzò (1911) che il nucleo fosse costituito da particelle cariche positivamente, dette protoni, in numero pari agli elettroni presenti negli orbitali atomici. I protoni erano stati osservati in anni precedenti (quando ancora si ignorava la presenza del nucleo) come nuovi costituenti di una radiazione proveniente da un tubo a raggi catodici che viaggiava in direzione opposta agli abituali raggi catodici e di essi si conoscevano la massa e la carica. La carica del protone è uguale a quella dell'elettrone, ma di segno opposto, (+1,6022·10-19 C), mentre la sua massa è circa 1860 volte maggiore di quella dell'elettrone (1,6726·10-27 kg).
La massa totale dei nuclei di alcuni elementi tuttavia, misurata ripetutamente in quegli anni da Rutherford e dai suoi collaboratori, che tentavano di dare giustificazione alla struttura del nucleo, non corrispondeva alla somma delle masse dei protoni presenti, ma era quasi doppia nella maggior parte degli elementi considerati. Questo li indusse a pensare che all'interno del nucleo fosse presente una seconda particella, elettricamente neutra, con una massa paragonabile a quella del protone (1,6749·10-27 kg), in numero quasi pari a quello dei protoni. Tale particella fu chiamata neutrone ed effettivamente osservata nel 1932 da un allievo di Rutherford, il fisico inglese J. Chadwick (v. tab. 25.1).
Neutroni e protoni vengono indicati anche come nucleoni.
Il numero dei protoni in un nucleo è il numero atomico Z e caratterizza un elemento chimico, mentre il numero totale dei nucleoni (dato dal numero di protoni più il numero di neutroni) è indicato come numero di massa, A. La differenza:
fornisce il numero dei neutroni, che può variare all'interno dei nuclei di uno stesso elemento.
Prendono il nome di isotopi nuclei di uno stesso elemento con uguale numero atomico e diverso numero di massa.
La notazione utilizzata per indicare un isotopo si riferisce alla composizione del nucleo considerato come un'entità a sé stante, detta nuclide, indicato dal simbolo dell'elemento, con il numero atomico Z scritto in basso a sinistra e il numero di massa A in alto a sinistra. Per esempio, nel caso del nucleo del carbonio (simbolo C) con Z = 6 e A = 12 il nuclide corrispondente è indicato come:
Il carbonio possiede altri isotopi, con differente A, tra cui:
Una seconda notazione più sintetica utilizzata per indicare gli isotopi di un elemento, omette il numero atomico (che per ogni elemento è fisso) e indica solo il numero di massa, per esempio 12C o, in alternativa, carbonio-12.
Il numero di protoni Z e il numero di neutroni N determinano la stabilità del nucleo: per taluni rapporti Z/N i nuclei sono stabili e tendono naturalmente a mantenere intatto il loro corredo di nucleoni, mentre i nuclei instabili, con rapporti diversi tra protoni e neutroni, tendono a trasformarsi, per perdita o acquisto di uno o più nucleoni, in un nucleo stabile, non necessariamente appartenente allo stesso elemento chimico (è questa la causa all'origine del fenomeno della radioattività ). Per Z bassi (fino a circa Z = 30) i nuclei stabili sono quelli che possiedono un numero di protoni pari al numero di neutroni, mentre per Z alti il numero di neutroni in un nucleo stabile tende a essere superiore al numero di protoni (l'eccesso di neutroni tende a stabilizzare i nuclei, perché allontanano i protoni, le cui cariche positive altrimenti darebbero luogo a elevatissime forze repulsive, tali da disgregare il nucleo). Se si costruisce un grafico dei nuclei noti, riportando in ascissa il numero atomico Z e in ordinata il numero di neutroni N, i nuclei stabili tendono a stare all'interno di una fascia, detta banda di stabilità (v. fig. 25.1), che per Z < 20 occupa la retta a 45°, corrispondente a N = Z, mentre, all'aumentare di Z, i nuclei stabili hanno N > Z.
La massa dei nucleoni, e di conseguenza quella dei nuclei degli elementi chimici, viene generalmente espressa in un'unità di misura diversa dal chilogrammo, detta unità di massa atomica (simbolo amu, dall'inglese atomic mass unit), dove 1 amu = 1,6604·10-27 kg è definita come 1/12 della massa del carbonio-12. Secondo tale unità il protone ha una massa pari a 1,0073 amu (approssimato a 1 amu), il neutrone di 1,0089 amu (~1 amu), mentre la massa dell'elettrone vale 0,000549 amu.
Le forze nucleari
Nell'atomo gli elettroni sono tenuti insieme al nucleo da forze di tipo elettrico, a causa dell'attrazione tra gli elettroni, negativi, e il nucleo, carico positivamente. Le forze elettriche non possono però giustificare la coesione tra i protoni all'interno del nucleo, che tenderebbero a respingersi a vicenda (repulsione coulombiana tra cariche dello stesso segno). Le forze di coesione tra i nucleoni nel nucleo devono perciò essere più forti delle forze di natura elettrica, per vincere la repulsione coulombiana. Per questo motivo la forza nucleare è detta interazione nucleare forte. L'interazione forte ha un'intensità molto elevata, ma ha un raggio d'azione estremamente piccolo, limitato alle dimensioni del nucleo (dell'ordine di 10-15 m), al di fuori del quale si annulla.
L'energia necessaria a vincere le forze nucleari e a estrarre un nucleone dal nucleo è molto maggiore di quella necessaria a estrarre un elettrone dalla sua orbita atomica (qualche milione di elettronvolt, o qualche megaelettronvolt, simbolo MeV, rispetto a una decina di elettronvolt, simbolo eV) ed è detta energia di legame. Di conseguenza le energie liberate nei processi di fissione (frantumazione) del nucleo sono molto maggiori di quelle liberate nelle reazioni chimiche.
L'energia di legame
Nella sua teoria della relatività speciale (o ristretta) formulata attorno al 1905, A. Einstein stabilì che un corpo di massa m possiede un'energia E data dalla seguente relazione, nota come equazione di Einstein:
dove c è la velocità della luce nel vuoto (costante).
Se si misurano la massa di un nucleo e la somma delle masse dei suoi componenti isolati (cioè liberi) si ottiene un risultato apparentemente sorprendente, cioè che la somma delle masse dei nucleoni è sempre maggiore della massa del nucleo nel suo complesso. In realtà questo è spiegabile alla luce dell'equazione di Einstein, se si pensa che all'atto della formazione del nucleo una parte della massa dei nucleoni, cioè la massa mancante, si è trasformata in energia, quella necessaria per tenerli insieme; questa stessa energia è quella che occorre fornire al nucleo per separare i nucleoni, ovvero è l'energia di legame. La differenza, m, tra la somma delle masse dei nucleoni e la massa del nucleo viene detta difetto di massa:
Al difetto di massa m corrisponde la quantità di energia
E data dall'equazione di Einstein:
che rappresenta l'energia di legame.
Per esempio, l'energia di legame del nucleo dell'isotopo dell'idrogeno 2
Il valore dell'energia di legame del deuterio risulta circa un milione di volte superiore all'energia elettrostatica che tiene unito l'elettrone al nucleo dell'idrogeno: circa 13,6 eV.
In una reazione nucleare, data l'entità delle energie coinvolte, si osservano sempre delle variazioni di massa (le variazioni che avvengono anche nelle reazioni chimiche non sono praticamente apprezzabili, perché le energie liberate sono di gran lunga inferiori). L'energia di legame media per nucleone, data dall'energia di legame divisa per il numero di massa (E/A), ha un valore
relativamente basso per i nuclei leggeri e cresce rapidamente fino ai nuclei con
numero di massa di circa 50; diminuisce poi andando verso i nuclei più pesanti
(ma più lentamente di quanto sia prima aumentata). Questo andamento lascia
prevedere che verrà liberata energia se due nuclei leggeri si uniscono (fusione)
per formare un nucleo più pesante, o se un nucleo pesante viene spezzato (fissione ) in due o più nuclei più leggeri.
I modelli nucleari
Analogamente al caso dell'atomo , la struttura del nucleo viene descritta tramite modelli schematici e relativamente approssimativi. Data l'impossibilità di descrivere con esattezza matematica le forze che tengono uniti i nucleoni, e dato il gran numero di particelle coinvolte, i modelli nucleari sono più complessi di quelli atomici e di conseguenza non verranno qui illustrati per esteso. Riassumendo le conoscenze fin qui raggiunte si può dire che esistono due principali modelli nucleari, a seconda che si tengano in considerazione o meno gli effetti prodotti dalle varie particelle sul moto di ognuna di esse.
Il modello a goccia descrive il nucleo come un liquido, nel quale le forze che tengono insieme i nucleoni sono analoghe a quelle che tengono insieme le molecole di un liquido in una goccia, quindi molto intense e a raggio d'azione limitato. Il modello a goccia è molto utile nella spiegazione delle reazioni che avvengono in nuclei altamente eccitati, ma risulta di poca utilità per la spiegazione degli stati fondamentali dei nucleoni.
Il modello a shell (strati) è analogo al modello usato per descrivere i livelli energetici degli elettroni nell'atomo e fornisce risultati interessanti sulla stabilità dei nuclei. Secondo questo modello i nucleoni si dispongono su livelli energetici nucleari secondo un principio analogo al riempimento degli orbitali atomici , caratterizzati da numeri analoghi ai numeri quantici, rispettando il principio di esclusione di Pauli, e al riempimento di determinati livelli corrispondono nuclei particolarmente stabili (analogamente a quello che accade negli atomi con i gas nobili). I nuclei con numero di nucleoni corrispondente a determinati numeri, detti numeri magici (2, 8, 20, 28, 50, 82 ecc.), presentano caratteristiche di stabilità ricorrenti.
Esistono poi modelli unificati che cercano di conciliare le due interpretazioni, nei quali le caratteristiche del nucleo vengono di volta in volta interpretate in base al moto dei singoli nucleoni (come nel modello a shell) o in termini di moto collettivo (come nel modello a goccia).
| ||||||||||||||||||||
Media correlati
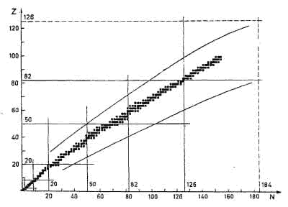
Figura 25.1 Banda di stabilità per i nuclei: sulla retta a 45°, corrispondente a N = Z, tendono a posizionarsi i nuclei stabili per Z bassi.


