Le proprietà della materia e le forze di coesione
Le forze, si è detto, agiscono sui corpi per modificarne
lo stato di quiete e di moto. Per lo studio delle forze e dei corpi, è
essenziale fare un breve cenno alla costituzione della materia e dei suoi stati
di aggregazione, dai quali dipendono le caratteristiche dei corpi stessi. La
materia trattata in senso macroscopico è tutto ciò che occupa un volume e ha una
massa; da un punto di vista microscopico, la materia è costituita di particelle
(atomi o aggregati di atomi detti molecole ). A seconda delle forze di coesione tra le particelle di un corpo, la materia si presenta nei suoi tre stati di aggregazione, solido, liquido o gassoso. Il volume V e la massa m di un corpo sono legati fra loro tramite la densità, simbolo , definita come il rapporto fra la massa e il volume del corpo stesso:
e la cui unità di misura nel Sistema Internazionale è il chilogrammo per metro cubo (kg/m3).
La densità di una sostanza diminuisce in genere con l'aumentare della temperatura (fatta eccezione per l'acqua, che mostra un aumento della densità tra 0 e 4 °C). I gas sono in genere le sostanze meno dense, mentre i solidi sono quelle a densità maggiore.
I corpi solidi sono quelli caratterizzati da un volume e da una forma definiti; i liquidi sono quelle sostanze dotate di un volume proprio, ma non di una forma propria, poiché tendono ad assumere la forma del recipiente che li contiene; le sostanze gassose (o aeriformi) non sono dotate né di forma né di volume propri e assumono quelli del contenitore (v. fig. 5.2). Il fatto che una sostanza assuma uno stato di aggregazione piuttosto che un altro dipende dalle forze di coesione tra le sue particelle costituenti e inoltre dalla temperatura e dalla pressione a cui la sostanza si trova. Variando questi due parametri, la sostanza passa da uno stato di aggregazione a un altro. Le forze di coesione tra le particelle di un corpo diminuiscono all'aumentare della distanza reciproca. I corpi solidi presentano nella maggior parte dei casi una struttura cristallina, dove le particelle sono rigidamente legate in strutture geometriche (reticoli cristallini) e le forze di coesione che le tengono legate sono molto forti (per cui le particelle possono solo compiere movimenti vibrazionali attorno a posizioni di equilibrio). Una minoranza di corpi solidi presenta una struttura disordinata (solidi amorfi).
Nei liquidi, le particelle costituenti sono più distanziate e le forze di coesione sono meno forti, mentre nei gas le particelle sono relativamente distanti, sono dotate di un movimento continuo e disordinato e le forze di coesione hanno un influsso minimo.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Media correlati
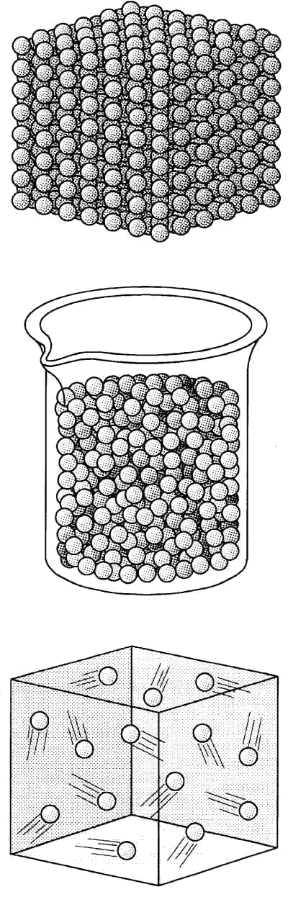
Figura 5.2 Stati di aggregazione della materia: A,stato solido cristallino; B, stato liquido; C, stato gassoso.


