Sistema periodico e configurazioni elettroniche
Il fatto che sia il numero atomico a determinare la posizione di un elemento nella tavola periodica ha un preciso significato: esiste infatti una relazione fra il numero atomico e la struttura elettronica: il numero atomico corrisponde infatti al numero di elettroni presenti in un atomo neutro . Gli elettroni possono disporsi intorno al nucleo atomico secondo determinati criteri, cioè andando a occupare livelli di energia via via crescenti a seconda della distanza dal nucleo. Questi livelli energetici sono determinati dal numero quantico principale n, che può assumere valori da 1 a 7: i sette periodi orizzontali del sistema periodico corrispondono proprio ai sette livelli energetici permessi. All'aumentare del valore del numero quantico, aumenta il numero dei sottolivelli od orbitali atomici che possono ospitare elettroni. Ogni volta che un livello si satura, cioè raggiunge il numero massimo di elettroni che può ospitare, si passa al livello successivo, e in corrispondenza si passa al periodo successivo del sistema periodico.
Il gruppo di elementi che segnano il termine di un periodo e il passaggio al periodo successivo è quello dei gas nobili, nei quali avviene il riempimento dei livelli energetici corrispondenti:
elettroni esterni
livello 1 = 1° periodo → l’elio (He) 2
livello 2 = 2° periodo → il neo (Ne) 8
livello 3 = 3° periodo → l’argo (Ar) 8
livello 4 = 4° periodo → il cripto (Kr) 8
livello 5 = 5° periodo → lo xeno (Xe) 8
livello 6 = 6° periodo → il rado (Rn) 8
Il comportamento chimico di un elemento (cioè di un certo tipo di atomo) è strettamente legato al numero di elettroni presenti nel livello energetico esterno (elettroni di valenza). Se, per esempio, uno stesso numero di elettroni di valenza è disposto in orbitali di tipo s , anche se appartenenti a differenti livelli (per esempio, 2s o 4s), gli elementi corrispondenti presentano proprietà chimiche e fisiche molto simili. In effetti, i vari sottogruppi A e B riuniscono elementi che hanno lo stesso numero di elettroni di valenza e per tale ragione manifestano un comportamento chimico relativamente omogeneo. La conclusione è che la ricorrenza periodica di elementi con proprietà simili deriva direttamente dalla ricorrenza periodica di configurazioni elettroniche simili dei livelli esterni dei corrispondenti atomi. Dopo il calcio (Z = 20) inizia, con lo scandio (Sc, Z = 21) la serie dei sottogruppi B, ordinati nella successione: III B, IV B, V B, VI B, VII B, VIII B, I B, II B.
Gli elementi dei sottogruppi B sono detti elementi di transizione, in quanto in essi avviene il riempimento di orbitali appartenenti a sottolivelli interni rispetto ai livelli di valenza e precisamente:
il sottolivello 3d per gli elementi dallo scandio (Z = 21) allo zinco (Z = 30) nel 4° periodo;
il sottolivello 4d per gli elementi dall'ittrio (Z = 39) al cadmio (Z = 48) nel 5° periodo;
i sottolivelli 5d e 4f dal lantanio (Z = 57) al mercurio (Z = 80) nel 6° periodo;
i sottolivelli 6d e 5f dall'attinio (Z = 89) in poi nel 7° periodo.
I periodi 6° e 7° comprendono due serie particolari ciascuna di 14 elementi di transizione: quella dei lantanidi e quella degli attinidi, in cui avviene il riempimento dei sottolivelli f del terzultimo livello, lasciando inalterate le configurazioni elettroniche del penultimo e dell'ultimo livello. Da ciò derivano le fortissime somiglianze tra i membri di ciascuna serie (v. fig. 4.2).
La figura va letta riga per riga e da sinistra verso destra. Gli elementi sono rappresentati dal loro numero atomico. I numeri a sinistra dei quattro insiemi di orbitali s, p, d, f rappresentano il numero quantico principale n di ogni orbitale.
Media correlati

Figura 4.1 TAVOLA PERIODICA DEGLI ELEMENTI
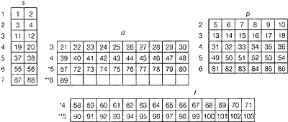
Figura 4.2 DISTRIBUZIONE DEGLI ELEMENTI IN RELAZIONE ALL'ORDINE DI RIEMPIMENTO DEGLI ORBITALI


