La vaporizzazione
La vaporizzazione è il passaggio dallo stato liquido allo stato aeriforme e può avvenire secondo due modalità distinte, l'evaporazione e l'ebollizione.
L'evaporazione è il passaggio da liquido a vapore che avviene in modo lento e regolare e interessa soltanto gli strati superficiali del liquido. Le particelle superficiali del liquido, meno legate di quelle interne, possono abbandonare il liquido e trasformarsi in vapore. L'evaporazione avviene a tutte le temperature, ma con diverse intensità: un aumento della temperatura infatti aumenta l'energia cinetica delle molecole del liquido e di conseguenza aumenta l'evaporazione. La quantità di particelle che evaporano dipende inoltre dalla superficie libera del liquido: più estesa è la superficie, maggiore è la probabilità che avvenga l'evaporazione. Se l'evaporazione avviene in ambiente chiuso, si raggiunge una condizione di equilibrio tra il liquido e il vapore tale per cui il numero delle particelle di liquido che si trasformano in vapore si mantiene nel tempo uguale al numero di particelle di vapore che si trasformano in liquido. In queste condizioni si dice che il vapore è saturo e la pressione alla quale si ha equilibrio è detta tensione di vapore (o pressione di vapore saturo). La tensione di vapore è diversa per ogni liquido e aumenta con la temperatura (v. fig. 12.1), ma è del tutto indipendente dalla massa del liquido. La tensione di vapore di una sostanza misura la sua volatilità, ovvero la sua capacità a evaporare, a una data temperatura: l'alcol, per esempio, è più volatile dell'acqua a temperatura ambiente.
Si definisce calore latente di evaporazione la quantità di calore necessaria a far evaporare una massa unitaria di liquido. Quando un liquido evapora, sottrae all'ambiente una quantità di calore pari al calore latente di evaporazione (tale calore verrà restituito durante il processo inverso). Questo spiega, per esempio, la sensazione di freddo che si prova quando il sudore evapora sulla nostra pelle.
L'ebollizione è il passaggio da liquido ad aeriforme (gas o vapore) che avviene in modo veloce e tumultuoso e interessa l'intera massa del liquido. In tutti i liquidi sono presenti bollicine gassose, nelle quali sono intrappolate molecole del liquido allo stato di gas o vapore. Quando la temperatura del liquido aumenta, le bollicine si dilatano e, quando la loro tensione di vapore coincide con la pressione esterna, si ha il fenomeno dell'ebollizione, nel quale le bollicine risalgono in superficie e liberano il vapore, o il gas, contenuto. L'ebollizione di un liquido, a una data pressione esterna, avviene a una determinata temperatura, detta temperatura di ebollizione (o punto di ebollizione), che resta costante durante tutto il processo di ebollizione. Si dice che il liquido bolle a quella determinata temperatura. La temperatura di ebollizione corrisponde alla temperatura alla quale la tensione di vapore del liquido uguaglia la pressione presente sulla superficie del liquido stesso. La temperatura di ebollizione varia con la pressione: aumenta all'aumentare della pressione esterna e diminuisce al diminuire della pressione esterna. Se diminuisce la pressione esterna, diminuisce la pressione alla quale può avvenire l'ebollizione, e di conseguenza quest'ultima può avvenire a temperatura più bassa, e viceversa all'aumentare della pressione esterna. La temperatura di ebollizione dell'acqua, per esempio, a pressione atmosferica normale (101,32 kPa), è di 100 °C; a pressioni pari a metà della pressione atmosferica normale (circa 50 kPa), condizione che si verifica per esempio a circa 5500 m di quota, l'acqua bolle a 86 °C. Aumentando la pressione esterna, l'acqua bolle a temperature superiori a 100 °C, come avviene per esempio nella pentola a pressione. La quantità di calore necessaria a provocare la completa ebollizione di una massa unitaria di liquido è detta calore latente di ebollizione. Nella tabella 12.3 sono indicati i valori delle temperature di ebollizione di alcuni liquidi a pressione normale e dei rispettivi calori latenti.
| |||||||||||||||||||||||||||||||||||||||||||
Media correlati
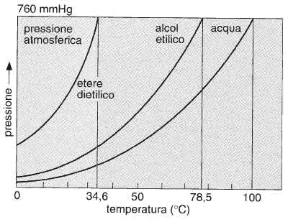
Figura 12.1 Variazione della tensione di vapore di tre liquidi in funzione della temperatura. Le temperature corrispondenti alle linee verticali sono quelle di ebollizione delle tre sostanze.


