L'atomo a più elettroni
L'atomo quantistico è costituito da un nucleo centrale, circondato da una serie di strati che corrispondono ai livelli energetici degli elettroni nel senso chiarito nel paragrafo precedente. A ogni livello energetico (caratterizzato dal numero n) corrispondono uno o più orbitali di forma differente e di diversa orientazione spaziale.
Ogni elettrone presente in un determinato orbitale viene identificato da quattro parametri, detti numeri quantici (v. tab. 24.1):
Numero quantico principale, n. Definisce il livello energetico dell'elettrone e può assumere valori interi e positivi:
Numero quantico secondario o azimutale, l. Definisce il numero dei sottolivelli energetici in cui si differenzia ciascun livello; ogni sottolivello corrisponde a orbitali aventi la stessa forma, definita dal valore di l che è compreso tra 0 e n − 1:
Per l = 0 si hanno orbitali di tipo s, a simmetria sferica (v. fig. 24.2 A); per l = 1 si hanno orbitali di tipo p (v. fig. 24.2 B); per l = 2 si hanno orbitali di tipo d con simmetria più complicata e così via.
Numero quantico magnetico, m. Definisce il numero di orbitali appartenenti a ciascun sottolivello e il loro orientamento nello spazio. Il numero quantico m può assumere tutti i valori compresi tra − l e + l, compreso lo zero. Le relazioni tra i valori di n, l e m e il tipo e il numero di orbitali corrispondenti ai sottolivelli sono indicati nella tabella 24.2 (limitatamente ai primi 3 livelli).
Numero quantico di spin, m
(i due valori dello spin vengono anche detti "su" e "giù", dall'inglese spin up e spin down).
Riempimento degli orbitali
I numeri quantici aiutano nella comprensione della struttura dell'atomo a più elettroni. I livelli e i relativi sottolivelli vengono riempiti di elettroni, all'aumentare del numero atomico Z, secondo regole relativamente semplici. La prima regola dice che ogni elettrone si trova nello stato di minima energia disponibile, ovvero che i primi livelli a venire riempiti sono quelli più interni (cioè più vicini al nucleo).
La seconda regola fondamentale, dovuta al fisico austriaco W. Pauli (1900-1978), nota come principio di esclusione, stabilisce che due elettroni in un atomo non possono avere la stessa quaterna di numeri quantici, ma devono differire per almeno uno di essi: in altre parole ciò significa che in uno stesso orbitale possono trovare posto al massimo due elettroni con spin opposto.
In base a queste regole il primo livello (n = 1) che ha un solo orbitale s, indicato con 1s, può contenere al massimo due elettroni; il secondo livello (n = 2) ha un orbitale 2s e tre orbitali 2p, che possono ospitare in tutto 8 elettroni (a coppie con spin opposto); il terzo livello (n = 3) ha un orbitale 3s, tre orbitali 3p e cinque orbitali 3d e così via.
La configurazione elettronica degli atomi è lo schema di distribuzione dei rispettivi elettroni nei vari livelli e sottolivelli energetici, cioè nei singoli orbitali atomici. L'atomo più semplice, quello di idrogeno (Z = 1), ha un solo elettrone nell'orbitale 1s, nel quale è disponibile un'altra posizione. L'atomo di elio (Z = 2) ha due elettroni nell'orbitale 1s, per cui il livello n = 1 è completo. Per gli atomi con Z compreso fra 3 e 10 gli elettroni occuperanno man mano le otto posizioni disponibili nel livello n = 2: due relative all'orbitale 2s e sei relative agli orbitali 2p (v. tab. 24.3). Per il riempimento degli orbitali p e dei successivi, prima che un altro elettrone possa venire inserito occorre che tutti gli orbitali di quel sottolivello contengano almeno un elettrone: è il caso per esempio dell'azoto, dove i tre elettroni degli orbitali p occupano tutti e tre gli orbitali con un elettrone e solo allora (per l'elemento successivo, che è l'ossigeno) il successivo elettrone si accoppierà al primo dei tre.
Gli elementi chimici vengono riuniti secondo uno schema noto come tavola periodica degli elementi. L'interpretazione della struttura atomica fornita in questo paragrafo spiega molte delle caratteristiche chimiche degli elementi. Quando il livello più esterno è completamente riempito, come succede per esempio nel caso dei gas nobili, l'atomo è particolarmente stabile. Per gli altri elementi il comportamento chimico è strettamente legato al numero di elettroni presenti nel livello energetico esterno (elettroni di valenza). Se, per esempio, uno stesso numero di elettroni di valenza è disposto in orbitali di tipo s, anche se appartenenti a differenti livelli(per esempio, 2s o 4s), gli elementi corrispondenti presentano proprietà chimiche e fisiche molto simili; in effetti i vari gruppi della tavola periodica riuniscono elementi che hanno lo stesso numero di elettroni di valenza e per tale ragione presentano un comportamento chimico relativamente omogeneo. La ricorrenza periodica di elementi con caratteristiche comuni deriva dalla ricorrenza periodica delle configurazioni elettroniche.
| ||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Media correlati
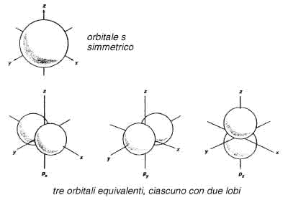
Figura 24.2 Orbitali di tipo s (A) e di tipo p (B), con le relative orientazioni spaziali.


