La meccanica ondulatoria e il legame chimico
L'uso delle formule di struttura e l'applicazione della regola dell'ottetto permettono di illustrare in modo qualitativo il legame covalente, ma non spiegano perché i legami covalenti si formano. La teoria della repulsione delle coppie di elettroni di valenza (VSEPR), benché utile per prevedere la forma delle molecole, non è in grado di spiegare come queste coppie di elettroni si sistemano nello spazio. Per conoscere più a fondo il comportamento degli elettroni nelle molecole, si ricorre ai principi della meccanica ondulatoria, gli stessi che hanno permesso di ricavare la configurazione elettronica degli atomi e la descrizione delle forme degli orbitali atomici. L'applicazione della meccanica ondulatoria alle molecole consente di capire come interagiscono fra di loro gli orbitali degli atomi quando si sovrappongono per formare legami. Sono stati formulati a questo proposito due metodi fondamentali: il metodo del legame di valenza (spesso indicato con la sigla VB, dall'inglese valence bond) e il metodo degli orbitali molecolari (sigla OM).
Il metodo del legame di valenza
Il metodo del legame di valenza (VB) ipotizza che il legame covalente tra due atomi si formi mediante sovrapposizione di due orbitali atomici (uno per ogni atomo) dove vanno a disporsi i due elettroni di legame, con spin antiparalleli. Per esempio, nel caso dell'idrogeno, si ha:
Per gli orbitali molecolari valgono regole di riempimento per gli elettroni analoghe a quelle viste per gli orbitali atomici, che si possono così riassumere:
- gli elettroni occupano prima i livelli più stabili e cioè a minor energia;
- in ogni orbitale molecolare possono stare al massimo due elettroni, con spin opposti (principio di Pauli);
- se sono disponibili orbitali molecolari con la stessa energia, gli elettroni tendono a occuparli singolarmente e con spin paralleli (regola di Hund);
- gli orbitali molecolari formano legami σ, σ*, π, π* (così come nel metodo del legame di valenza);
- una molecola può esistere solo se il numero di elettroni che si trovano sugli orbitali molecolari leganti supera quello degli elettroni che occupano orbitali molecolari antileganti (nel caso dell'idrogeno questo è verificato).
Media correlati
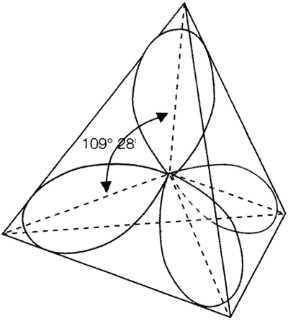
Figura 5.2 IBRIDAZIONE sp3 DELL'ATOMO DI CARBONIO
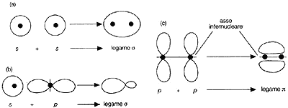
Figura 5.3 RAPPRESENTAZIONE DEI LEGAMI σ E π


