Verso la meccanica quantistica
La meccanica quantistica è la parte della fisica che studia i sistemi atomici e subatomici (molecole, atomi, nuclei, particelle ecc.), le cui dimensioni sono dell'ordine di 10-10 m o inferiori e per i quali non valgono le leggi della meccanica classica, in grado di descrivere il moto di sistemi macroscopici. La meccanica quantistica prese il via dalle contraddizioni ravvisate nel comportamento di alcuni sistemi fisici, comportamento che non poteva essere spiegato secondo le leggi della fisica classica. La formulazione matematica della meccanica quantistica venne compiuta dopo il 1925 per opera del fisico tedesco W. Heisenberg (1901-1976) e dell'austriaco E. Schrödinger (1887-1961), ma fu preceduta da una teoria provvisoria (la teoria dei quanti) formulata nel 1900 dal fisico tedesco M. Planck (1858-1947). Planck, nel tentativo di spiegare la radiazione emessa da un corpo perfettamente assorbente, detto "corpo nero", introdusse il concetto di quantizzazione dell'energia della radiazione elettromagnetica, per cui l'energia può assumere solo valori multipli interi di un valore fondamentale, detto quanto. Lo stesso Planck non considerava definitiva l'introduzione del quanto di energia, ma lo riteneva un mero artificio di calcolo per ricavare la curva che descrive l'emissione dei corpi caldi; quando però questo risultò utile per spiegare fenomeni non descrivibili altrimenti, la teoria dei quanti venne accettata e costituì la base concettuale sulla quale si sviluppò l'edificio della meccanica quantistica.
L'avvento della teoria dei quanti e la meccanica quantistica che ne seguì rappresentano uno di quei casi in cui in fisica una vecchia teoria (che in questo caso è rappresentata dall'intero impianto della meccanica classica e dell'elettromagnetismo) non viene abbandonata, ma rimpiazzata da una nuova teoria soltanto per alcuni casi (i sistemi di dimensioni microscopiche). Il moto dei corpi macroscopici continua ad avere una corretta interpretazione nella meccanica classica, ma per il moto delle particelle di dimensioni atomiche e subatomiche bisogna ricorrere alla meccanica quantistica. Anche la radiazione elettromagnetica, che risulta per molti suoi comportamenti perfettamente spiegabile attraverso le leggi dell'elettromagnetismo classico, ha in determinati casi un comportamento quantistico.
Proprietà corpuscolari della radiazione elettromagnetica
Un corpo caldo emette radiazione elettromagnetica, la cui frequenza varia secondo la temperatura. Anche i corpi a temperatura ambiente emettono radiazione elettromagnetica, sotto forma di radiazione infrarossa (calore); all'aumentare della temperatura del corpo, aumenta la frequenza della radiazione emessa e si passa dall'infrarosso al visibile e all'ultravioletto. Per studiare lo spettro di emissione di un corpo caldo si fa uso in fisica di un modello, rappresentato da un corpo emissivo ideale, detto corpo nero, che assorbe tutta la radiazione che riceve e di conseguenza emette radiazione di tutte le lunghezze d'onda. Per simulare sperimentalmente un corpo nero, si ricorre in genere a un corpo cavo che comunichi con l'esterno attraverso un piccolo foro. Quando la radiazione incide sulla cavità, la parte di radiazione che entra nel foro rimane intrappolata, subisce innumerevoli riflessioni e viene completamente assorbita: il foro quindi si può considerare con buona approssimazione un corpo nero.
La quantità totale di energia emessa dal corpo nero è direttamente proporzionale alla quarta potenza della temperatura (legge di Stefan-Boltzmann), mentre la curva che rappresenta l'intensità dell'emissione in funzione della frequenza (lo spettro) presenta un massimo di emissione in corrispondenza di una frequenza caratteristica, che varia a seconda della temperatura (v. fig. 24.1). Lo spettro di emissione di un corpo nero è indipendente dal materiale di cui è costituita la cavità e dipende solo dalla sua temperatura, ma la forma della curva non è spiegabile attraverso le leggi della fisica classica che descrivono la radiazione elettromagnetica.
Nel 1900 M. Planck trovò la legge che descrive la curva di questo spettro, introducendo però un’ipotesi del tutto nuova, ovvero che gli scambi energetici tra la radiazione elettromagnetica e la materia possono avvenire solo per multipli interi di una quantità elementare:
dove è la frequenza della radiazione e h una costante di proporzionalità, detta costante di Plank, che vale 6,626.10-34 Js.
L'energia, dunque, non assume valori continui, ma discreti, multipli di una quantità che Planck chiamò quanto: l'energia di ciascun quanto, in base alla (1), è direttamente proporzionale alla frequenza della radiazione (e quindi inversamente proporzionale alla sua lunghezza d'onda).
La prima conferma dell'esistenza dei quanti venne data pochi anni più tardi da A. Einstein (1879-1955), che nel 1905 propose un'interpretazione per un altro fenomeno che non trovava spiegazione secondo le leggi della fisica classica, l'effetto fotoelettrico (su cui si basano le cellule fotoelettriche oggi largamente usate).
L'effetto fotoelettrico consiste nell'emissione di elettroni da parte di una sostanza colpita da radiazione luminosa. Il fenomeno si può verificare attraverso un apparato strumentale costituito da due lamine metalliche separate tra loro e collegate da un circuito elettrico, poste all'interno di un'ampolla di vetro in cui sia stato fatto il vuoto. Se una delle due lamine viene investita da radiazione luminosa di determinate lunghezze d'onda, nel circuito si produce corrente: ciò significa che la lamina emette elettroni, i quali, colpendo la seconda lamina, chiudono il circuito. L'intensità della corrente (quindi il numero degli elettroni emessi) dipende dall'intensità della radiazione luminosa, ma esiste una frequenza minima (detta frequenza di soglia) al di sotto della quale non si verifica alcuna emissione, indipendentemente dall'intensità della luce incidente. Per spiegare questa seconda caratteristica, che non trova riscontri nella teoria classica della radiazione luminosa, Einstein propose che la luce viaggiasse sotto forma di "pacchetti discreti" di energia, i quanti, o fotoni (come vennero chiamati in seguito), la cui energia è proporzionale alla frequenza secondo la relazione (1) stabilita da Planck. Soltanto quando l'energia di un singolo fotone è uguale o maggiore all'energia che tiene legato l'elettrone all'atomo del metallo, questo viene emesso. Il numero di elettroni emessi dipende dunque dalla quantità dei fotoni incidenti in possesso dell'energia sufficiente (l'intensità della radiazione) e dalla loro frequenza.
L'energia E di un quanto di luce, ricordando che la frequenza e la lunghezza d'onda
della radiazione elettromagnetica sono legate dalla relazione
è data da:
dove h è la costante di Planck e c è la velocità della luce.
Un aspetto importante connesso al fenomeno dell'effetto fotoelettrico è che l'interazione tra i fotoni e gli elettroni degli atomi deve avvenire secondo il modello degli urti tra particelle: da questo punto di vista, i fotoni si possono considerare alla stregua di corpuscoli.
Dopo una lunga serie di interpretazioni diverse sulla sua natura, la luce (e in generale la radiazione elettromagnetica) torna a essere considerata come un fascio composto di particelle (concezione che ricorda la teoria corpuscolare della luce formulata da Newton). In realtà, la concezione ondulatoria della luce non viene affatto abbandonata a seguito di questa nuova interpretazione, ma si ammette che la luce possegga una doppia natura, ondulatoria e particellare (o corpuscolare), e che ne riveli l'una o l'altra a seconda del tipo di esperimento effettuato. La meccanica quantistica ha indicato inoltre che questa doppia natura non è propria solo delle onde elettromagnetiche, ma anche delle particelle elementari, quali per esempio l'elettrone, il protone e il neutrone, che mostrano in determinate condizioni un comportamento tipicamente ondulatorio. Questo concetto viene ricordato con l'espressione dualismo onda-particella.
Proprietà ondulatorie della materia
In analogia con il fatto che la luce possiede per certi aspetti le caratteristiche proprie della materia, ovvero che si può considerare composta di particelle elementari (i fotoni), il fisico francese L.V. de Broglie (1892-1987) propose nel 1924 che le particelle materiali, come gli elettroni, i protoni e i neutroni, avessero alcune proprietà caratteristiche delle onde e che tali caratteristiche fossero esprimibili attraverso i concetti di lunghezza d'onda e frequenza. In particolare egli affermò che a ogni particella potesse essere associata un'onda di lunghezza d'onda , detta lunghezza d'onda di de Broglie, pari a:
dove p = mv è il modulo della quantità di moto del corpo e h la costante di Planck.
L'ipotesi di de Broglie ebbe una conferma sperimentale qualche anno più tardi, quando vennero eseguiti esperimenti di diffrazione attraverso una doppia fenditura utilizzando fasci di particelle. Facendo passare un fascio di elettroni attraverso una doppia fenditura e raccogliendo il fascio su una lastra fotografica, si ottiene una figura del tutto simile alla figura di interferenza che si ottiene con la radiazione luminosa , costituita da frange alternativamente luminose e buie, caratteristica dei fenomeni ondulatori.
La lunghezza d'onda di un elettrone, accelerato attraverso una differenza di potenziale di 103 V è = 10-11 m, cioè dello stesso ordine di grandezza della lunghezza d'onda dei raggi X e delle distanze interatomiche. Per questo motivo gli elettroni possono venire usati, come anche i raggi X, per indagare la struttura interna dei cristalli, dove gli atomi sono tenuti insieme rigidamente secondo strutture geometriche regolari: la struttura attraverso la quale gli atomi sono legati tra loro funge da reticolo di diffrazione per le particelle incidenti e l'interpretazione della figura di interferenza rivela la disposizione degli atomi.
Il principio di indeterminazione
Poiché la fisica si basa sull'osservazione di entità misurabili, anche le caratteristiche dei corpi microscopici e delle onde devono essere misurabili. I due aspetti della natura delle particelle e della radiazione, quello ondulatorio e quello corpuscolare, possono venire verificati attraverso gli esperimenti descritti. Esiste però una limitazione alla misurabilità di alcune caratteristiche delle particelle, che fu espressa da Heisenberg attraverso il principio di indeterminazione. Quando si osserva il comportamento di un corpo macroscopico - per esempio, il moto di una palla da biliardo - l'osservazione del fenomeno non interferisce con il fenomeno stesso ed è possibile definire con una certa esattezza la sua posizione e la sua velocità (salvo errori di misura, v. cap. 1). Se però si tratta di stabilire la velocità (o analogamente la quantità di moto) e la posizione di un elettrone - per esempio, utilizzando un fascio di luce - l'osservazione interferisce sulla misura, poiché le lunghezze d'onda dei due corpi hanno ordini di grandezza paragonabili e la quantità di moto della particella da misurare verrà alterata dall'urto con i fotoni. Il principio di indeterminazione di Heisenberg stabilisce che è impossibile misurare contemporaneamente con esattezza la posizione x e la quantità di moto p di una particella elementare. Il prodotto delle due indeterminazioni nelle misure (cioè degli errori che si compiono nell'effettuare la misura) non può essere inferiore al valore della costante di Planck divisa per 2, ovvero vale la relazione:
dove x rappresenta l'incertezza nella misura della posizione,
p l'incertezza nella misura della quantità di moto e h è la costante di Planck. Ne consegue che tanto maggiore è la precisione di una delle due misure tanto minore sarà la precisione della seconda. Il principio di indeterminazione è intrinseco, cioè non dipende dal tipo di particella né dal sistema di osservazione: è il processo di misurazione stesso che perturba il sistema osservato. Questo principio vale anche per i corpi macroscopici, per esempio anche per la palla da biliardo, ma data l'esiguità della costante di Planck è apprezzabile solo nel caso del mondo microscopico.
Media correlati
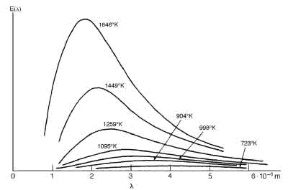
Figura 24.1 Lo spettro di radiazione del corpo nero. Le curve corrispondono a diversi valori della temperatura assoluta, in funzione della lunghezza d'onda della radiazione emessa.


