Il secondo principio della termodinamica
Secondo il primo principio della termodinamica non esiste limitazione teorica al passaggio di calore da un corpo più freddo a uno più caldo, poiché anche questa eventualità soddisfa il principio di conservazione dell'energia. Si può dimostrare questa affermazione con un semplice esempio: se si pone un cubetto di acciaio freddo in un bicchiere di acqua calda, sperimentalmente si osserva che l'acciaio si scalda e l'acqua si raffredda. Per il primo principio della termodinamica, infatti, l'acqua cede parte della sua energia interna all'acciaio, che si riscalda. Sempre per il primo principio, però, poteva verificarsi teoricamente anche che l'acqua si riscaldasse ulteriormente, aumentando la sua energia interna, e l'acciaio si raffreddasse ulteriormente, diminuendo la sua energia interna della medesima quantità, poiché anche questa seconda possibilità rispetta il principio di conservazione dell'energia. Questa osservazione ha aperto la strada al secondo principio della termodinamica, che afferma, nella sua forma più semplice, dovuta al fisico tedesco R. Clausius (1822-1888), che il calore non può passare spontaneamente da un corpo più freddo a uno più caldo.
Il secondo principio ha una grande rilevanza per le macchine termiche, che convertono calore in lavoro; nella formulazione che si deve a lord Kelvin (che, come vedremo poco oltre è equivalente a quella di Clausius), stabilisce che, mentre il lavoro può sempre e integralmente essere convertito in calore, ciò non avviene per il passaggio inverso, ovvero è impossibile realizzare una trasformazione il cui unico risultato sia quello di assorbire calore da una sorgente e trasformarlo integralmente in lavoro. Il secondo principio della termodinamica pone, in sostanza, le limitazioni alle quali è soggetta la trasformazione di calore in lavoro.
Per dimostrare l'uguaglianza tra le due formulazioni (di Clausius e di Kelvin) del secondo principio bisogna procedere per assurdo, ipotizzando cioè che una delle due sia falsa e dimostrare che risulta falsa anche la seconda. Se, per esempio, si assume che il postulato di Kelvin sia falso, sarebbe possibile, utilizzando il calore fornito da una sorgente, ottenere come unico risultato lavoro. Se, per esempio, la sorgente si trovasse a temperatura T
Viceversa, se si suppone falso l'enunciato di Clausius, si teorizza la possibilità di operare una trasformazione che abbia come risultato il passaggio di calore da un corpo a temperatura minore T
In definitiva, il secondo principio della termodinamica sostiene che una macchina termica, per operare, richiede almeno due scambi di calore con due sorgenti a diversa temperatura, con cessione di calore alla più fredda e assorbimento di calore dalla più calda. Questo perché, nelle trasformazioni cicliche tipiche delle macchine termiche (che richiedono che le condizioni finali coincidano con quelle iniziali), non tutto il calore preso da un'unica sorgente può essere trasformato completamente in lavoro: una parte del calore che non si trasforma in lavoro (e che non va ad aumentare l'energia interna del sistema) deve venire ceduta a un'altra sorgente - per esempio, all'ambiente circostante - e in definitiva viene persa.
Il rendimento di una macchina termica
Si definisce rendimento di una macchina termica il rapporto tra il lavoro L compiuto dalla macchina e il calore Q
Poiché il lavoro in una macchina termica è L = Q Q
Il rendimento quindi rappresenta la frazione del calore fornito alla macchina effettivamente utilizzabile per produrre lavoro. Il secondo principio della termodinamica implica che il rendimento di una macchina termica sia sempre inferiore a 1.
Il ciclo di Carnot
Il ciclo di Carnot è un particolare tipo di ciclo termodinamico, studiato dal fisico francese S.N. Carnot (1796-1832), che rappresenta il ciclo ideale di trasformazioni termodinamiche seguito da un qualsiasi motore termico (per esempio, il motore di un'automobile o un motore a vapore). Il ciclo di Carnot consente di determinare il rendimento massimo raggiungibile da un motore termico. Si svolge in quattro fasi distinte, rappresentabili sul piano p,V attraverso due curve isoterme e due curve adiabatiche, attraverso cui il sistema torna alla posizione di partenza (v. fig. 14.3). Nella prima fase (da 1 a 2) di espansione isoterma (a temperatura costante) il sistema (per esempio, un gas) si espande e assorbe una quantità di calore Q
Il rendimento, definito come il rapporto tra il lavoro erogato e il calore assorbito, può essere espresso dalla formula:
dove T
Nel ciclo di Carnot è possibile invertire il senso di percorrenza del ciclo, assorbendo calore dalla sorgente fredda e cedendolo alla sorgente calda. In questo modo il ciclo assorbe lavoro invece di erogarlo: è ciò che avviene in un frigorifero domestico, nel quale il motore assorbe energia elettrica per sottrarre calore dall'interno del frigorifero e trasferirlo all'ambiente esterno.
Media correlati
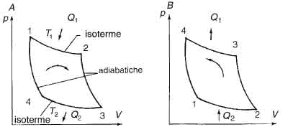
Figura 14.3 Rappresentazione schematica del ciclo di Carnot nel piano p,V: il significato delle curve è descritto nella figura A. In B il ciclo percorso in senso antiorario, detto ciclo frigorifero.Il rendimento nel ciclo di Carnot


