Trasformazione di energia elettrica in energia chimica: elettrolisi
Si chiama elettrolisi il complesso di fenomeni che avvengono quando soluzioni di elettroliti o elettroliti allo stato fuso sono attraversati dalla corrente elettrica. Il processo, grazie al quale l'energia elettrica fornita da un generatore di corrente continua rende possibile il verificarsi di reazioni chimiche non spontanee, viene realizzato in celle elettrolitiche, che sono recipienti contenenti l'elettrolita nel quale è immersa una coppia di elettrodi (costituiti da conduttori metallici) collegati ai poli di un generatore (una pila o un accumulatore): l'elettrodo collegato al polo positivo si chiama anodo, quello collegato al polo negativo catodo . L'elettrolisi ha numerose applicazioni.
Descrizione del processo
Sotto l'azione del campo elettrico generato dagli elettrodi, gli ioni con carica positiva presenti nell'elettrolita (cationi) migrano verso il catodo, quelli di carica negativa (anioni) verso l'anodo; al catodo si verificano reazioni di riduzione, all'anodo reazioni di ossidazione. Se nella cella è presente un elettrolita fuso, per esempio, cloruro di sodio (NaCl), agli elettrodi si verificano le seguenti reazioni (v. fig. 15.2):
dove F (faraday) è la carica elettrica di una mole di elettroni (= 96.500 C) necessaria per la scarica di un equivalente (meq = 2/M) di qualsiasi sostanza; z è la carica dello ione e M la sua massa atomica relativa.
Si definisce equivalente elettrochimico (eq. e.) la massa in grammi di sostanza che reagisce all'elettrodo al passaggio di una carica di un coulomb:
Media correlati
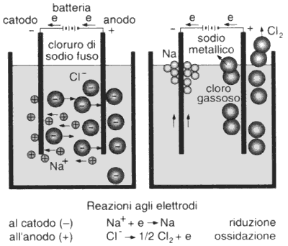
Figura 15.2 ELETTROLISI Schema del processo di elettrolisi del cloruro di sodio NaCl. Stabilita una differenza di potenziale tra catodo e anodo, al catodo migrano gli ioni positivi (cationi Na+), mentre all'anodo migrano gli ioni negativi (anioni Cl−). Al catodo si verifica un processo di riduzione e all'anodo un processo di ossidazione, tali per cui al catodo si deposita sodio metallico e all'anodo si sviluppa cloro gassoso.


