L'equilibrio chimico
Una reazione chimica si dice completa quando i reagenti si trasformano completamente nei prodotti. Per esempio, la reazione:
assume il valore Kc che soddisfa le condizioni di equilibrio (si tratta di un equilibrio dinamico, in quanto la reazione diretta e quella inversa continuano a procedere, ma con uguali velocità).
Fattori che influenzano la posizione dell'equilibrio
Un aumento della temperatura di reazione innalza il valore della costante di equilibrio delle reazioni che avvengono con assorbimento di calore (endotermiche), agevolando la trasformazione dei reattivi nei prodotti; viceversa, la costante delle reazioni che avvengono con sviluppo di calore (esotermiche), aumenta al diminuire della temperatura.
Un aumento di pressione, per le reazioni allo stato gassoso nelle quali si verifica una variazione di volume (ossia, variazione del numero di moli) agevola la reazione nel corso della quale diminuisce il numero di moli.
Le concentrazioni di reattivi e prodotti, in base alla legge di massa, influenzano notevolmente la posizione dell'equilibrio: per esempio, un eccesso di anche uno solo dei reattivi, o di uno solo dei prodotti, sposta l'equilibrio verso destra o, rispettivamente, verso sinistra.
Le influenze dei vari fattori sulla posizione dell'equilibrio sono espresse, in termini qualitativi, dal principio dell'equilibrio mobile (o di Le Chatelier-Brown): quando un sistema all'equilibrio è perturbato, l'equilibrio si sposterà in modo tale da controbilanciare l'effetto subìto dalla perturbazione e ristabilire un nuovo equilibrio.
Media correlati
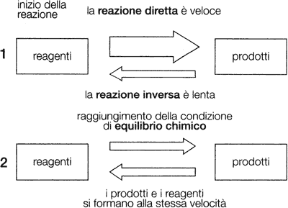
Figura 12.3 CONFRONTO TRA LA SITUAZIONE INIZIALE, 1, E LA SITUAZIONE IN CUI SI RAGGIUNGE L'EQUILIBRIO, 2, IN UNA REAZIONE CHIMICA


