Teoria delle collisioni
In base al modello proposto dalla teoria delle collisioni, una reazione chimica si verifica quando:
1. le particelle di reagenti (atomi, ioni, molecole) si urtano tra di loro; 2. gli urti sono efficaci, cioè hanno luogo tra particelle disposte con una orientazione reciproca favorevole e avvengono tra particelle che possiedono un'energia cinetica sufficiente a vincere le forze repulsive elettrostatiche tra le rispettive nubi elettroniche. In queste condizioni le nubi elettroniche dei reagenti si compenetrano, formando un composto intermedio ad alta energia, detto complesso attivato, nel quale avviene il riarrangiamento degli elettroni di legame tra gli atomi che dà origine alle nuove strutture corrispondenti ai prodotti di reazione.
Le particelle che danno luogo a urti efficaci sono soltanto quelle che posseggono un'energia cinetica uguale o superiore all'energia del complesso attivato: la differenza tra il contenuto energetico dei reagenti e l'energia del complesso attivato è chiamata energia di attivazione (Ea) (v. fig. 12.2).
L'energia di attivazione è una ``barriera energetica'' che i reagenti devono superare per poter reagire tra di loro ed è il fattore da cui dipende essenzialmente la velocità di una reazione chimica: più piccola è l'energia di attivazione, meno energia si deve fornire ai reagenti (per esempio, sotto forma di calore) per formare il complesso attivato, e quindi più rapida è la reazione.
In base alla teoria delle collisioni e alla nozione di energia di attivazione, è possibile interpretare l'effetto dei fattori che influenzano la velocità di reazione, come riassunto nella tabella 12.1, e comprendere il fatto che alcune reazioni avvengono attraverso un meccanismo a stadi.
| ||||||||||||||
Media correlati
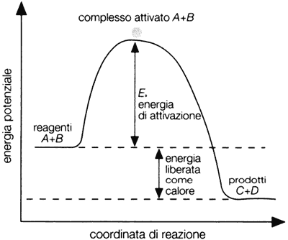
Figura 12.2 DIAGRAMMA DI VARIAZIONE DELL'ENERGIA POTENZIALE
Per una generica reazione esotermica A+B → C+D, la differenza tra l'energia del complesso attivato A+B e quello dei reagenti iniziati A+B rappresenta l'energia di attivazione.


